3D打印构建“精密”肿瘤转移模型
对于肿瘤细胞,3D培养方法在表型和基因型方面能让细胞更接近体内的行为。然而,肿瘤微环境何其复杂,虽然有研究人员将肿瘤细胞与其他细胞如成纤维细胞共培养,也有人建立了血管化模型,但还是有些“单薄”无法精确模拟肿瘤的转移环境。近日,来自美国明尼苏达大学的研究人员利用3D生物打印技术,构建了一种新型的“精密”的3D体外肿瘤模型。可以精确放置活细胞(肿瘤细胞,基质细胞和血管细胞)构建功能性的脉管系统,同时可以放置信号分子并控制其释放来引导肿瘤细胞转移。重要的是,将肿瘤靶向药物导入血管可以进行药物筛选。这个模型几乎完美地动态重现了癌症转移的几个关键步骤包括侵袭、血管内渗和血管生成,对于肿瘤的研究和新型抗癌药物的筛选具有重大意义。研究结果发表于《Advanced Materials》(IF=21.950)。
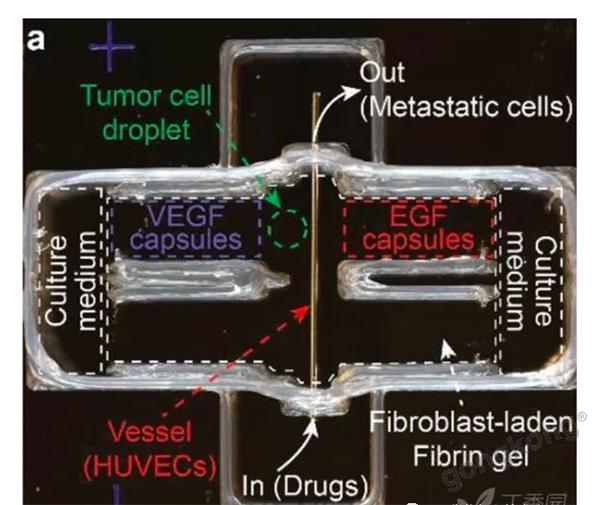
该模型有四大模块,可以精确模拟肿瘤转移环境:(1)肿瘤基质。选择水凝胶作为支架,水凝胶中含有成纤维细胞,用来构成肿瘤基质。(2)化学环境。3D打印的微胶囊包含趋化通路分子,如VEGF和EGF,在外界刺激下(胶囊外壳响应近红外激光)可动态释放这些化学信号,用来模拟肿瘤组织中的化学环境并指引细胞迁移。(3)血管系统。将人脐静脉内皮细胞(HUVECs)注入微通道进行内皮化,作为血管导管,以便肿瘤细胞穿过内皮屏障到达血管,产生循环肿瘤细胞(CTCs)。(4)肿瘤细胞。将肿瘤细胞簇置入打印的液滴隔室,模拟肿瘤的原发部位。
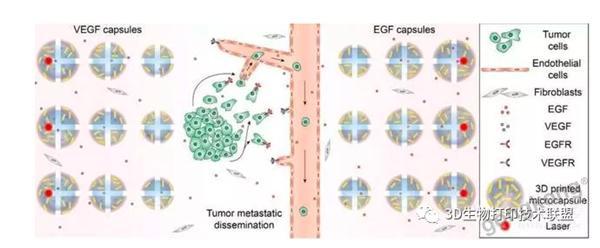
▲3D打印的体外肿瘤模型,模拟肿瘤细胞的转移。3D打印的可编程胶囊梯度释放EGF和VEGF,介导肿瘤细胞对肿瘤基质的侵袭和血管内渗入。EGF:表皮生长因子; VEGF:血管内皮生长因子; EGFR:EGF受体;VEGFR:VEGF受体。
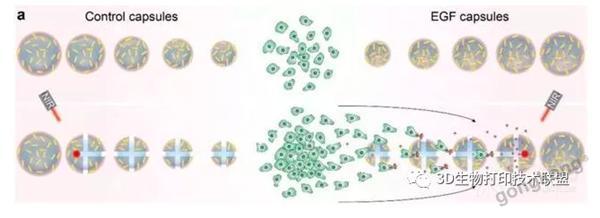
▲胶囊释放的EGF可用于引导肿瘤细胞迁移。大多数肿瘤细胞(A549肺癌细胞)仅在EGF胶囊区域中发现并且随着更多胶囊破裂而增加。
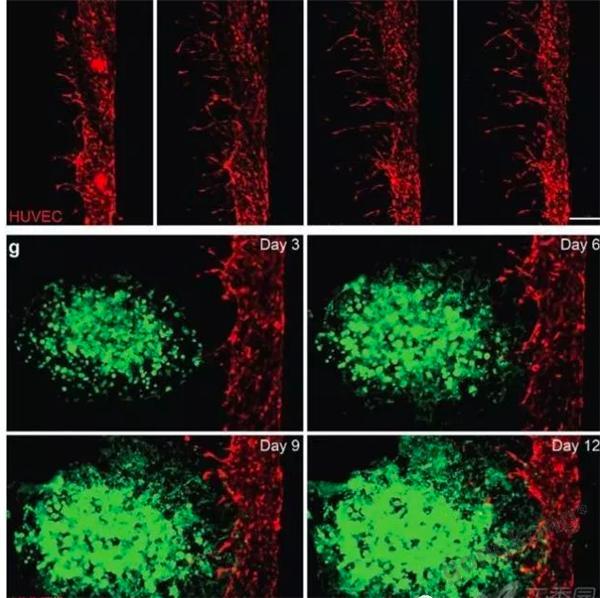
▲VEGF胶囊诱导主血管出芽,A549细胞进入脉管系统。
渗透到血管中的肿瘤细胞作为CTCs在血管流动,并且可以在独立的腔室内被收集。可以对富集的CTCs进行特异性分析。
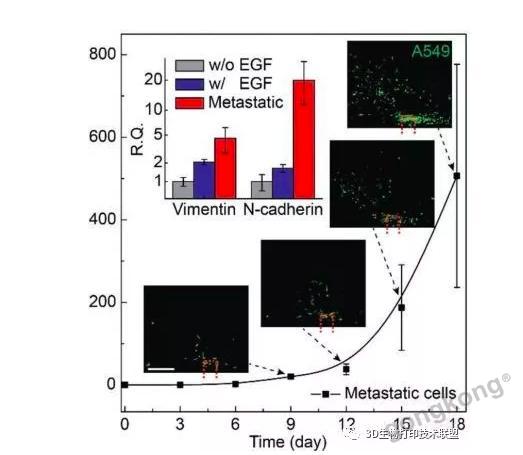
▲在富集的A549肺癌细胞中,波形蛋白和N-钙粘蛋白上调。
该3D生物打印肿瘤模型可作为药物筛选的临床前工具。通过血管引入两种免疫毒素药物EGF4KDEL和CD22KDEL。EGF4KDEL由EGF和截短的假单胞菌外毒素组成,靶向EGFR过表达的A549肿瘤细胞。与无药物治疗组相比,肿瘤细胞的增殖显著减少,并且未观察到引导入侵和迁移。由于A549不表达CD22,它们不受CD22KDEL的影响,表现出快速增殖和引导入侵。
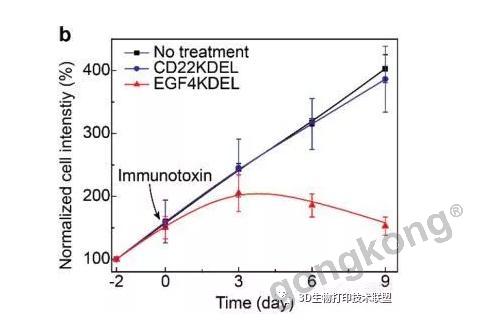
▲利用该模型进行药物筛选
尽管这种模型并不能完全概括体内肿瘤微环境的复杂性,但其极大化地缩短了传统2D单层细胞培养和动物模型之间的差距。同时推进了3D组织工程研究。该研究团队的下一步计划是加入更多的细胞类型,特别是免疫系统细胞,并研究这些细胞之间的相互作用。
提交
2025中欧绿色建筑工业化论坛9月北京启幕 全球智慧共推建筑产业“双碳”转型
喜讯!华强电子网荣获“2025年中国产业互联网创新企业”
深入实施“人工智能+”行动 浪潮软件集团看好人工智能+工业质检广阔前景,持续布局线缆行业智能质检
海尔新增2家卓越级智能工厂,总数品类行业双第一
深度剖析格力打破磁悬浮压缩机国外垄断,底气来自对自主创新的坚守!








 投诉建议
投诉建议